2024年第二十四期|国际眼科药物研发资讯速递
Time: Nov 14,2024
6/17-6/23 眼科药物国际资讯
Ocular Therapeutix™ 在投资者日重点介绍了旗下AXPAXLI™ SOL-1治疗wAMD的临床试验入组和重复给药研究(SOL-R)计划,以及HELIOS NPDR临床试验的 48周积极数据
Ocular Therapeutix(纳斯达克股票代码:OCUL)是一家生物制药公司,致力于通过开发和商业化湿性年龄相关性黄斑变性(wAMD)、糖尿病视网膜病变和其他眼部疾病和病症的创新疗法来提高人们的视力和生活质量。其近日举办了投资者日活动,重点介绍了AXPAXLI在湿性年龄相关性黄斑变性(wAMD)和非增殖性糖尿病视网膜病变(NPDR)的出色临床开发进展,并更新了公司战略。AXPAXLI是一种在研生物可吸收的水凝胶植入物,含有阿昔替尼,一种具有抗血管生成特性的小分子、多靶点酪氨酸激酶抑制剂,正在评估用于治疗wAMD、DR和其他视网膜疾病的疗效和安全性。其关键3期 SOL-1 试验旨在评估 AXPAXLI 在一项多中心、双盲、随机(1:1)平行组研究中的安全性和有效性。1期HELIOS试验是一项在美国进行的多中心、双盲、随机(2:1)平行组研究,该研究旨在评估 AXPAXLI 与假对照相比,在无中心受累糖尿病黄斑水肿(CI-DME)的中重度至重度非增殖性糖尿病视网膜病变(NPDR)受试者中的安全性、耐受性和有效性。活动主要公布内容包括:(1)截至 2024 年 6 月 7 日,151 名受试者参加了AXPAXLI 治疗wAMD 的 SOL-1 关键研究,处于不同阶段的入组和随机化分配;(2)宣布计划进行SOL-R研究,以评估wAMD中重复给药AXPAXLI;(3)48 周的 HELIOS NPDR结果显示,AXPAXLI 组中 23.1% 的患者经历了 ≥2 步 DRSS 改善,没有患者出现 DRSS 恶化或威胁视力的并发症。
RevOpsis与Kemwell Biopharma达成生产战略合作伙伴关系,以加快新型多特异性生物制剂的开发

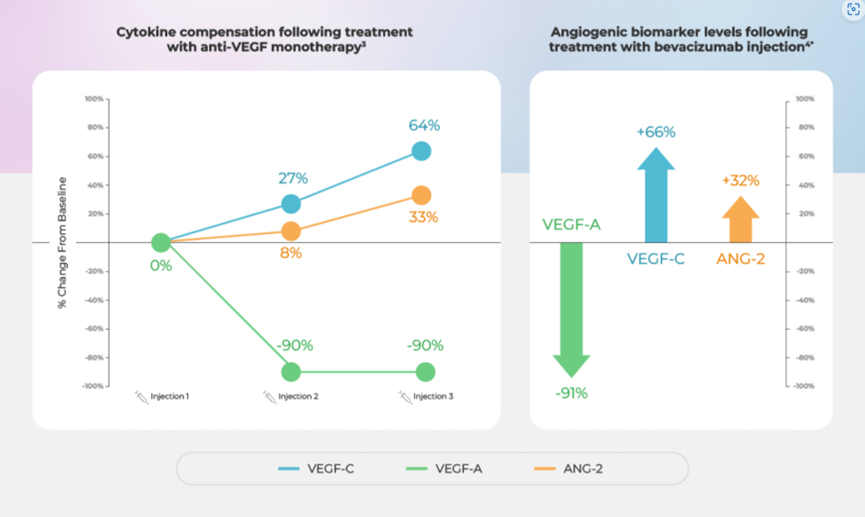
RevOpsis Therapeutics是一家引领多特异性眼科疗法创新的新一代生物制药公司。Kemwell Biopharma是一家领先的生物制剂CDMO。近日两家企业宣布建立广泛的战略生产合作伙伴关系。此次合作旨在加速RevOpsis的主要候选药物RO-104的开发。RO-104是一种用于治疗新生血管性年龄相关性黄斑变性(nAMD)的同类首创三特异性生物制剂。根据此次合作,Kemwell将生产RO-104,旨在靶向三种主要的血管生成途径(VEGF-A、VEGF-C、Ang-2),用于治疗nAMD。RO-104 同时结合这三个经过验证的靶点的独特能力使其成为一流的全人源单一疗法生物制剂,有望重新定义视网膜血管疾病的治疗格局。
Alvotech和Advanz Pharma签署Eylea® LD/HD生物类似药在欧洲的商业化协议
Alvotech(纳斯达克股票代码:ALVO),一家全球生物技术公司,专门为全球患者开发和生产生物类似药,其总部位于英国,战略重点是欧洲的专科、医院和罕见病药物。其近日宣布,两家公司已就Alvotech拟向Eylea(阿柏西普)提出的生物类似药的供应和商业化达成独家合作协议。Alvotech目前正在开发AVT06(一种Eylea低剂量(2毫克)生物类似药)和AVT29(一种Eylea高剂量(8毫克)的生物类似药)。根据协议,Alvotech将负责AVT06和AVT29的开发和商业供应,Advanz Pharma将负责注册和商业化。Advanz Pharma在欧洲拥有独家商业化权,但德国和法国除外,这些权利是半独家的。商业化协议包括向Alvotech支付预付款,并在某些开发和商业化里程碑后支付后续款项。2024 年 1 月,Alvotech公布了一项验证性患者研究的积极顶线结果,该研究评估了 AVT06 与 Eylea 相比在新生血管性(湿性)AMD 患者中的疗效、安全性和免疫原性。该研究达到了主要终点,结果表明Alvotech的生物类似药与Eylea之间的治疗等效性。
Aurion Biotech的候选药物AURN001获得突破性疗法认定和再生医学先进疗法认定
Aurion Biotech是通过改变生活的再生疗法为数百万患者恢复视力,其近日宣布美国食品和药物管理局(FDA)已授予AURN001突破性疗法认定(BTD)和再生医学先进疗法(RMAT)认定。AURN001是该公司的同种异体细胞疗法候选药物,用于治疗继发于角膜内皮疾病的角膜水肿。突破性疗法认定是一个旨在加快旨在治疗严重疾病的药物的开发和审查的过程。初步临床证据表明,该药物可能在具有临床意义的终点上表现出比现有疗法更有实质性改善。
Ocugen宣布旗下在研药物OCU400的3期liMeliGhT临床试验完成首例患者给药——首个具有广泛视网膜色素变性的3期基因疗法

Ocugen(纳斯达克股票代码:OCGN)是一家专注于发现、开发和商业化新型基因和细胞疗法及疫苗的生物技术公司。其近日宣布旗下在研药物OCU400 的 3 期 liMeliGhT 临床试验已为首例患者给药。OCU400 是一种在研用于治疗视网膜色素变性(RP)的修饰基因治疗候选产品。3 期 liMeliGhT 临床试验以 1/2 期 OCU400 阳性数据为依据,该数据表明,在接受治疗的眼睛中,最佳矫正视力(BCVA)和多亮度移动性测试(MLMT)以及低亮度视力(LLVA)呈积极趋势。89% (16/18)的 RP 受试者在 BCVA 或 LLVA 或 MLMT 评分方面表现出治疗保留或改善。80%(8/10)的柔突变受试者的 MLMT 评分相对于基线有所保留或改善。78%(14/18)的受试者在 MLMT 评分中表现出治疗眼睛比基线保留或改善。为期一年的 3 期研究样本量为 150 名参与者,其中一组 75 名参与者RHO基因突变和另一组有 75 名与基因无关的参与者。在每组中,参与者将以 2:1 的比例随机分配到治疗组和未治疗的对照组。目前正在招募 8 岁及以上、RP 早期到晚期进展的患者参加 liMeliGhT 研究。亮度依赖性导航评估 (LDNA) 是一种比之前 3 期临床试验中使用的 MLMT更灵敏、更特异的功能测量方法,也是该研究的主要终点。3 期 liMeliGhT 研究将重点关注治疗组和未治疗组的反应者比例,在研究眼中实现至少 2 Lux 水平的改善。
Neurotech Pharmaceuticals获得NT-501(revakinagene taroretcel)治疗2型黄斑毛细血管扩张症(MacTel)的生物制品许可申请(BLA)的优先审评
Neurotech Pharmaceuticals是慢性视网膜疾病持续给药的创新企业。近日美国食品和药物管理局(FDA)已确定NT-501(一种用于治疗MacTel的在研细胞疗法)的生物许可申请(BLA)已足够完整,可以进行实质性审查。MacTel是一种进行性视网膜神经退行性疾病,可导致中心视力恶化,严重影响患者的生活质量。NT-501 是一种眼部植入物,旨在持续给药治疗剂量的睫状神经营养因子(CNTF)直接输送到视网膜以减缓疾病的进展。
相关新闻


